Adenoviridae
อะดีโนไวรัส (อังกฤษ: adenovirus ในวงศ์ Adenoviridae ) เป็นไวรัสขนาดกลาง (90–100 นาโนเมตร) ไม่มีชั้นลิพิดหุ้มด้านนอก (nonenveloped) และมีเปลือกหุ้มวัสดุยีน คือแคปซิด (capsid) ทรงยี่สิบหน้า (icosahedral) ซึ่งบรรจุจีโนมอันเป็นดีเอ็นเอสายคู่ ชื่อมาจากแหล่งที่ดั้งเดิมสะกัดเอาไวรัสได้คือจากทอนซิลคอหอย (adenoid) ของมนุษย์ในปี 1953[1]
| อะดีโนไวรัส (Adenovirus) | |
|---|---|
| |
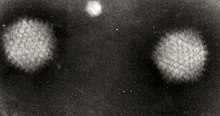
| ภาพกล้องจุลทรรศน์อิเล็กตรอนชนิดส่องผ่าน (TEM) ของอนุภาคอะดีโนไวรัสสองหน่วย | |
| การจำแนกชนิดไวรัส | |
| ไม่ได้จัดลำดับ: | ไวรัส Virus |
| อาณาจักร: | Bamfordvirae Bamfordvirae |
| ไฟลัม: | Preplasmiviricota Preplasmiviricota |
| ชั้น: | Tectiliviricetes Tectiliviricetes |
| อันดับ: | Rowavirales Rowavirales |
| วงศ์: | Adenoviridae Adenoviridae |
| Genera | |
| |
ไวรัสมีสัตว์ถูกเบียน (host) เป็นสัตว์มีกระดูกสันหลังมากมาย ในมนุษย์ พบอะดีโนไวรัสสายพันธุ์ต่าง ๆ กว่า 50 เซโรไทป์ (serotype)[A] ที่เป็นเหตุให้เกิดโรคมากมายหลายหลาก เริ่มจากการติดเชื้อทางเดินหายใจแบบอ่อน ๆ ในเด็ก (คือหวัดธรรมดา) จนกระทั่งโรคที่มีผลต่อระบบอวัยวะหลายระบบและมีอันตรายถึงชีวิตในบุคคลที่มีภูมิคุ้มกันอ่อนแอ
วิทยาไวรัส
แก้หมวดหมู่
แก้วงศ์ไวรัสนี้มีสกุลดังต่อไปนี้
- สกุล Atadenovirus มีสปีชีส์ต้นแบบ คือ Ovine atadenovirus D เป็นไวรัสติดเชื้อในแกะ
- สกุล Aviadenovirus มีสปีชีส์ต้นแบบ คือ Fowl aviadenovirus A เป็นไวรัสติดเชื้อในนก
- สกุล Ichtadenovirus มีสปีชีส์ต้นแบบ คือ Sturgeon ichtadenovirus A เป็นไวรัสติดเชื้อในปลา
- สกุล Mastadenovirus (รวมอะดีโนไวรัสของมนุษย์ทั้งหมด) มีสปีชีส์ต้นแบบ คือ Human mastadenovirus C
- สกุล Siadenovirus มีสปีชีส์ต้นแบบ คือ Frog siadenovirus A เป็นไวรัสติดเชื้อในกบ
ความหลากหลาย
แก้การจัดหมวดหมู่ Adenoviridae อาจซับซ้อน ปัจจุบันมีอะดีโนไวรัสของมนุษย์ (HAdVs) 88 เซโรไทป์[A] โดยรวมอยู่ใน 7 สปีชีส์ คืออะดีโนไวรัสมนุษย์ A ถึง G)[5]
- A: 12, 18, 31
- B: 3, 7, 11, 14, 16, 21, 34, 35, 50, 55
- C: 1, 2, 5, 6, 57[6]
- D: 8, 9, 10, 13, 15, 17, 19, 20, 22, 23, 24, 25, 26, 27, 28, 29, 30, 32, 33, 36, 37, 38, 39, 42, 43, 44, 45, 46, 47, 48, 49, 51, 53, 54, 56,[7] 58, 59, 60, 62, 63,[8] 64, 65, 67, 69,[9] 70, 71, 72, 73, 74, 75
- E: 4
- F: 40, 41
- G: 52[10]
เซโรไทป์ต่าง ๆ สัมพันธ์กับโรคต่าง ๆ กัน คือ
- โรคระบบหายใจ (สปีชีส์หลักคือ HAdV-B และ C)
- เยื่อตาอักเสบ (HAdV-B และ D)
- กระเพาะอาหารและลำไส้อักเสบ (HAdV-F 40 และ 41, HAdV-G 52)
- โรคอ้วนหรือ adipogenesis (HAdV-A 31, HAdV-C 5, HAdV-D 9, 36 และ 37)[11]
ไวรัสเหล่านี้จัดเป็น Human mastadenovirus A-G โดยคณะกรรมการ International Committee on Taxonomy of Viruses (ICTV) เพราะทั้งหมดอยู่ในสกุล Mastadenovirus เมื่อไม่จำกัดเพียงแค่ไวรัสในมนุษย์ วงศ์ Adenoviridae แบ่งออกเป็น 5 สกุลคือ Mastadenovirus, Aviadenovirus, Atadenovirus, Siadenovirus และ Ichtadenovirus[12]
โครงสร้าง
แก้อะดีโนไวรัสเป็นไวรัสที่ไม่มีชั้นลิพิดหุ้มด้านนอก (nonenveloped) กลุ่มใหญ่ที่สุดซึ่งรู้จัก จึงสามารถเข้าไปในเซลล์ผ่านเอนโดโซมได้เลย (สำหรับไวรัสที่มีสิ่งหุ้ม สิ่งหุ้มจะหลอมเข้ากับเยื่อหุ้มเซลล์ทำให้แคปซิดและจีโนมของไวรัสเข้าไปในเซลล์ได้) อนุภาคไวรัสมีลักษณะพิเศษเป็นเดือยแหลม (spike) เป็นใย (fiber) ที่อยู่กับฐานรูปห้าเหลี่ยม (penton base) แต่ละฐานของแคปซิด (ดูรูปต่อไป) ที่ช่วยให้ยึดเข้ากับเซลล์ถูกเบียนผ่านหน่วยรับที่ผิวของเซลล์ (ดูหัวข้อ "การถ่ายแบบ" ด้านล่างเรื่องหน่วยรับต่าง ๆ)
ในปี 2010 นักวิทยาศาสตร์ประกาศว่าได้ระบุโครงสร้างอะดีโนไวรัสของมนุษย์ในระดับอะตอม และได้สร้างแบบจำลองอันละเอียดสุดเท่าที่เคยมี ไวรัสประกอบด้วยเรซิดิว[B] กรดอะมิโน 1 ล้านเรซิดิวและหนักราว ๆ 150 ล้านดอลตัน (150 MDa)[13][14]
จีโนม
แก้จีโนมของอะดีโนไวรัสมีรูปเส้น ไม่แบ่งส่วน เป็นดีเอ็นเอสายคู่ ยาวประมาณ 26–48 กิโลคู่เบส (Kbp) ซึ่งโดยทฤษฎีสามารถรับรองยีนได้ 22–40 ยีน แม้นี่จะใหญ่กว่าอย่างสำคัญเมื่อเทียบกับไวรัสอื่น ๆ ในกลุ่มบอลทิมอร์ของไวรัส แต่ก็ยังเป็นไวรัสง่าย ๆ และต้องอาศัยเซลล์ถูกเบียนอย่างมากเพื่อการอยู่รอดและถ่ายโอนยีน ลักษณะที่น่าสนใจของจีโนมไวรัสนี้ก็คือมันมีโปรตีนหนัก 55 กิโลดอลตันที่ปลาย 5' ของดีเอ็นเอที่เป็นสายคู่เส้นตรง (linear dsDNA) ซึ่งใช้เป็นไพรเมอร์ (primer)[C] สำหรับการถ่ายแบบไวรัส และเพื่อให้แน่นอนว่า ปลายจีโนมของไวรัสได้ทำซ้ำอย่างสมควร
การถ่ายแบบ
แก้อะดีโนไวรัสมีจีโนมเป็นดีเอ็นเอนสายคู่เส้นตรง (linear dsDNA) และสามารถถ่ายแบบซ้ำในนิวเคลียสของเซลล์สัตว์มีกระดูกสันหลังโดยใช้กลไกถ่ายแบบของเซลล์ถูกเบียนและไม่ต้องรวมเข้ากับจีโนมของเซลล์ถูกเบียน
การเข้าไปในเซลล์ของอะดีโนไวรัสเป็นปฏิสัมพันธ์สองขั้นตอนระหว่างไวรัสกับเซลล์ถูกเบียน ปฏิกิริยาโดยมากเกิดที่จุดยอด ๆ ของไวรัส เริ่มด้วย knob domain ของโปรตีนที่เป็นใยไปเชื่อมเข้ากับหน่วยรับที่เซลล์ หน่วยรับที่เซลล์สองอย่างที่ระบุแล้วคือหน่วยรับ CD46 สำหรับไวรัสมนุษย์กลุ่ม B และหน่วยรับ coxsackievirus/adenovirus receptor (CAR) สำหรับเซโรไทป์[A]อื่น ๆ ทั้งหมด มีรายงานที่แสดงนัยว่าโมเลกุล major histocompatibility complex (MHC) และเรซิดิว[B]ของ sialic acid ของเซลล์ก็ทำหน้าที่แบบนี้ด้วย แล้วตามด้วยปฏิบัติการลำดับที่สอง ซึ่ง motif ของโปรตีนฐานมีห้าเหลี่ยมของไวรัสมีปฏิสัมพันธ์กับโมเลกุล integrin (ซึ่งเป็น transmembrane receptor) ที่จัดเป็นหน่วยรับร่วม (co-receptor) ที่เยื่อหุ้มเซลล์
ปฏิสัมพันธ์กับหน่วยรับร่วม αv integrin นี้ทำให้อะดีโนไวรัสเข้าไปในเซลล์ได้ โดยการเข้ายึดกับ αv integrin มีผลเป็นกระบวนการ endocytosis คือการรับอนุภาคไวรัสเข้าไปในเซลล์ผ่านหลุมที่เคลือบด้วย clathrin (คือ clathrin-coated pits) การเข้ายึดกับ αv integrin ยังกระตุ้นการส่งสัญญาณของเซลล์ (cell signaling) ซึ่งชักนำให้เกิดพอลิเมอไรเซชันของแอกติน แล้วมีผลให้อนุภาคไวรัสเข้าไปในเซลล์ภายในเอนโดโซม[16]
เมื่อไวรัสเข้าไปในเซลล์แล้ว เอนโดโซมก็จะกลายเป็นกรด ซึ่งเปลี่ยนโครงแบบของไวรัสโดยสลายองค์ประกอบของแคปซิด แคปซิดที่สลายตัวก็จะปล่อยโปรตีน VI[17] การเปลี่ยนแปลงเช่นนี้บวกกับความเป็นพิษของฐานรูปห้าเหลี่ยมก็จะทำลายเอนโดโซม เป็นการปล่อยอนุภาคไวรัสเข้าไปในไซโทพลาซึม แล้วไวรัสก็จะขนส่งโดยอาศัยไมโครทิวบูลในเซลล์ไปที่โปรตีนเชิงซ้อนรูนิวเคลียส (nuclear pore complex)[E] เป็นที่ที่อนุภาคไวรัสจะแตกแยกตัว ปล่อยดีเอ็นเอของไวรัสออกมา แล้วเข้าไปยังนิวเคลียสของเซลล์ผ่านรูนิวเคลียส (nuclear pore)[E][19] หลังจากนี้ ดีเอ็นเอของไวรัสก็จะทำปฏิกิริยากับโมเลกุลฮิสโตน การแสดงออกของยีนไวรัสก็จะสามารถเกิดได้โดยไม่ต้องรวมจีโนมไวรัสเข้ากับโครโมโซมของเซลล์ถูกเบียน แล้วสร้างอนุภาคไวรัสใหม่ ๆ ได้
วัฏจักรชีวิตของอะดีโนไวรัสจะแบ่งออกเป็นสองช่วงแยกโดยการถ่ายแบบดีเอ็นเอ คือ ช่วงต้นและช่วงท้าย ในช่วงทั้งสอง primary transcript[F] จะผ่านกระบวนการ alternative splicing[G] เพื่อสร้างเอ็มอาร์เอ็นเอแบบ monocistronic[H] ที่เข้ากับไรโบโซมของเซลล์ถูกเบียนได้ จึงทำให้ไรโบโซมแปลรหัสเป็นผลิตภัณฑ์ของยีนไวรัสได้
ยีนช่วงต้น (early gene) แสดงออกโปรตีนที่ไม่ใช่โครงสร้าง (non-structural) แต่ใช้ในการควบคุม (regulatory) โดยมาก โดยมีเป้าหมาย 3 อย่าง คือ เพื่อเปลี่ยนการแสดงออกโปรตีนของเซลล์ถูกเบียนที่จำเป็นในการสังเคราะห์ดีเอ็นเอ เพื่อก่อกัมมันต์แก่ยีนของไวรัสอื่น ๆ (เช่น DNA polymerase ที่ไวรัสเข้ารหัส) และเพื่อไม่ให้เซลล์ถูกเบียนตายเร็วเนื่องกับระบบภูมิคุ้มกันของสัตว์ถูกเบียน (เช่น โดยระงับกระบวนการอะพอพโทซิส ระงับไม่ให้อินเตอร์เฟียรอนทำงาน และระงับการแสดงออกและการเคลื่อนย้ายของ MHC class I)
อะดีโนไวรัสบางอย่างในสถานการณ์พิเศษสามารถแปลงเซลล์โดยใช้ผลิตภัณฑ์ยีนช่วงต้น เช่น โปรตีนของ adenovirus early region 1A (E1A) ซึ่งเข้ายึดกับโปรตีนระงับมะเร็งจอตา (Retinoblastoma tumor suppressor protein) ได้พบว่าทำให้เซลล์ถูกเบียนปฐมภูมิมีชีวิตต่อได้นอกกาย (in vitro) จึงทำให้โปรตีน E1B ซึ่งเชื่อมกับยีนระงับเนื้องอก p53 tumor suppressor ช่วยแปลงเซลล์ได้อย่างเสถียร แต่ยีนเหล่านี้ต้องอาศัยกันและกันเพื่อให้เปลี่ยนเซลล์ถูกเบียนได้อย่างสำเร็จแล้วสร้างเนื้องอก
การถ่ายแบบดีเอ็นเอแบ่งเป็นช่วงต้นและปลาย เมื่อยีนช่วงต้นได้ก่อโปรตีนไวรัส ก่อกลไกการถ่ายแบบ และก่อซับสเตรตในการถ่ายแบบพอสมควร การถ่ายแบบจีโนมของอะดีโนไวรัสก็จะเริ่มได้ โปรตีนปลายที่ยึดด้วยพันธะโคเวเลนต์เข้าที่ปลายด้าน 5’ ของจีโนมอะดีโนไวรัสทำหน้าที่เป็นไพรเมอร์[C]ในการถ่ายแบบยีน โดยเอนไซม์ไวรัสคือ DNA polymerase ก็จะใช้กลไก strand displacement (ไม่ได้ใช้กลไก Okazaki fragments ที่ใช้ในการถ่ายแบบดีเอ็นเอของสัตว์เลี้ยงลูกด้วยนม) เพื่อถ่ายแบบจีโนมของไวรัส
ช่วงหลังของวัฏจักรชีวิตจะมุ่งผลิตโปรตีนโครงสร้างพอให้บรรจุวัสดุยีนที่ได้จากการถ่ายแบบดีเอ็นเอ หลังจากองค์ประกอบไวรัสได้ทำขึ้นพอแล้ว ก็จะบรรจุใส่โปรตีนที่เป็นเปลือกหุ้มแล้วออกจากเซลล์หลังจากชักนำให้เซลล์สลายตัว (lysis)
Multiplicity reactivation
แก้อะดีโนไวรัสสามารถรวมตัวขึ้นมาใหม่อาศัยกระบวนการ multiplicity reactivation (MR)[23] เป็นกระบวนการที่จีโนมไวรัสสองตัวหรือยิ่งกว่าที่เกิดความเสียหายจนแพร่พันธุ์ไม่ได้มีปฏิสัมพันธ์ภายในเซลล์ถูกเบียนแล้วสร้างจีโนมไวรัสใหม่ที่แพร่พันธุ์ต่อไปได้ กระบวนการ MR นี้ ได้พบในอะดีโนไวรัสเซโรไทป์ 12 หลังจากอนุภาคไวรัสฉายแล้วด้วยรังสีอัลตราไวโอเลตแล้วปล่อยให้เซลล์ถูกเบียนติดเชื้อหลายครั้ง[23] งานทบทวนวรรณกรรมวิทยาศาสตร์ยังแสดงตัวอย่าง MR ในไวรัสต่าง ๆ จึงได้เสนอว่า MR เป็นปฏิสัมพันธ์ทางเพศที่สามัญอย่างหนึ่งซึ่งให้ความได้เปรียบในการรอดชีวิตเพราะช่วยซ่อมความเสียหายต่อจีโนมด้วยการผสมยีน[24]
วิทยาการระบาด
แก้การแพร่เชื้อ
แก้อะดีโนไวรัสปกติจะทนต่อสารเคมี สิ่งแวดล้อม และความเป็นกรดต่าง ๆ จึงสามารถรอดชีวิตอยู่นอกร่างกายและนอกน้ำได้นาน โดยหลักจะแพร่กระจายไปตามหยดน้ำจากทางเดินหายใจ แต่ก็สามารถกระจายไปทางอุจจาระได้ งานวิจัยในเรื่องกลไกทางอณูชีวภาพของการแพร่เชื้อได้ให้หลักฐานเชิงประสบการณ์เพื่อสนับสนุนสมมติฐานว่า หน่วยรับที่ผิวเซลล์ coxsackievirus/adenovirus receptor (CAR) จำเป็นเพื่อขนส่งอะดีโนไวรัสไข้าไปในเซลล์แบบ naive/progenitor บางชนิด[25]
มนุษย์
แก้มนุษย์ที่ติดเชื้ออะดีโนไวรัสจะตอบสนองในหลายรูปแบบ เริ่มตั้งแต่ไม่มีอาการอะไรเลย จนถึงติดเชื้ออย่างรุนแรงที่ปกติพบในอะดีโนไวรัสเซโรไทป์ 14
สัตว์ต่าง ๆ
แก้อะดีโนไวรัส คือ bat adenovirus TJM (Bt-AdV-TJM) เป็นสปีชีสใหม่ในสกุล Mastadenovirus ที่ได้ตัวอย่างจากค้างคาว Myotis[I] และ Scotophilus kuhlii [J] ในประเทศจีน ซึ่งเป็นญาติใกล้ชิดที่สุดกับอะดีโนไวรัสของกระแตและสุนัข[27]
อะดีโนไวรัสของสุนัขสองชนิดรู้จักกันดีคือชนิดที่ 1 และ 2 ชนิดที่ 1 (Canine adenovirus 1 ตัวย่อ CAdV-1) ทำให้เกิดโรคตับสุนัขแบบแพร่เชื้อ (infectious canine hepatitis) ซึ่งอาจทำให้ถึงตายโดยมีอาการเป็นเส้นเลือดอักเสบ (vasculitis) และตับอักเสบ และอาจทำให้เกิดการติดเชื้อทางลมหายใจหรือที่ตา ชนิดนี้ยังติดหมาจิ้งจอก (หมาจิ้งจอกแดงและหมาจิ้งจอกอาร์กติก) โดยอาจก่อตับอักเสบและสมองอักเสบ ส่วนชนิดที่ 2 (CAdV-2) อาจเป็นเหตุของโรค kennel cough (โรคไอในคอกสุนัข) วัคซีนหลัก ๆ สำหรับสุนัขรวมวัคซีนไวรัส CAdV-2 เป็น ๆ แต่ลดฤทธิ์โดยสร้างภูมิคุ้มกันต่อไวรัสทั้ง CAdV-1 และ CAdV-2 ก่อนนี้ ไวรัส CAdV-1 ก็ใช้เป็นวัคซีนด้วยแต่ก็มีภาวะแทรกซ้อนสามัญคือ กระจกตาบวมน้ำ (corneal edema)[28]
อะดีโนไวรัสของกระรอก (SqAdV) รายงานว่าก่อลำไส้เล็กอักเสบในกระรอกแดงในยุโรป แต่กระรอกเทาดูเหมือนจะมีภูมิต้านทาน SqAdV เป็นญาติใกล้ชิดกับอะดีโนไวรัสของหนูตะเภา (GpAdV)
อะดีโนไวรัสในสัตว์เลื้อยคลาน (Agamid Adenovirus) ไม่ค่อยมีข้อมูล แต่ก็มีงานวิจัยอยู่ในปัจจุบัน
อะดีโนไวรัสรู้ว่าทำให้ม้า วัวควาย หมู และแพะติดเชื้อทางลมหายใจ ประเภท Equine adenovirus 1 ทำให้เกิดโรคถึงตายในลูกม้าอาหรับที่ภูมิคุ้มกันอ่อนแอ โดยก่อปอดบวมและทำลายเนื้อเยื่อตับอ่อนและต่อมน้ำลาย[28]
Tupaia adenovirus (tree shrew adenovirus 1, TAV) ได้ตัวอย่างมาจากกระแต ส่วน Otarine adenovirus 1 ได้ตัวอย่างมาจากสิงโตทะเลแคลิฟอร์เนีย[29]
อะดีโนไวรัสจากสัตว์ปีกเลี้ยงสัมพันธ์กับโรคสัตว์ปีกเลี้ยงมากมาย เช่น ตับอักเสบที่มีอินคลูชั่นบอดี้ (inclusion body hepatitis), ภาวะถุงหุ้มหัวใจมีน้ำ (hydropericardium syndrome)[30], โรคไข่นิ่ม (Egg drop syndrome), Quail bronchitis, กระเพาะบดมีแผลลอกหลุด (Gizzard erosions) และโรคทางเดินหายใจอื่น ๆ โดยยังได้ตัวอย่างมาจากเหยี่ยวดำป่า (Milvus migrans) อีกด้วย[31]
อะดีโนไวรัสลิงได้จากลิงอเมริกาใต้คือ Titi monkey[32]
การป้องกัน
แก้ปัจจุบัน มีแต่วัคซีนป้องกันอะดีโนไวรัสเซโรไทป์ 4 และ 7 สำหรับทหารสหรัฐเท่านั้น ที่เฉพาะสำหรับทหารก็เพราะมีความเสี่ยงติดเชื้อสูงสุด เป็นวัคซีนที่ใช้ไวรัสเป็น ๆ ซึ่งอาจกระจายไปตามอุจจาระและสามารถแพร่เชื้อต่อไปได้ ปัจจุบันยังไม่มีวัคซีนที่อนุมัติให้ใช้กับคนทั่วไป วัคซีนนี้ไม่ได้อนุมัติให้ใช้นอกจากทหาร เพราะไม่มีงานศึกษาที่ทำกับคนทั่วไปหรือกับคนที่ภูมิคุ้มกันอ่อนแอ[33]
ในอดีต ทหารใหม่ของกองทัพสหรัฐได้วัคซีนต่อต้านอะดีโนไวรัสสองเซโรไทป์ จึงป่วยเป็นโรคที่สัมพันธ์กับเซโรไทป์เหล่านั้นน้อยลง แต่ผู้ผลิตก็ไม่ทำวัคซีนเหล่านี้อีกต่อไป
การป้องกันการติดเชื้ออะดีโนไวรัสและโรคทางเดินหายใจอื่น ๆ รวมการล้างมือบ่อย ๆ ให้มากกว่า 20 วินาที ไม่แตะตา หน้า หรือจมูกด้วยมือที่ไม่ได้ล้าง และหลีกเลี่ยงการใกล้ชิดกับบุคคลที่มีอาการติดเชื้ออะดีโนไวรัส คนที่มีอาการติดเชื้อยังแนะนำให้ไอหรือจามเข้าในแขนหรือข้อศอกแทนในมือ อย่าร่วมใช้ถ้วยและอุปกรณ์การกิน และหลีกเลี่ยงจูบคนอื่น การใส่คลอรีนในสระว่ายน้ำสามารถป้องกันการระบาดโรคเยื่อตาอักเสบเหตุอะดีโนไวรัสได้[33]
วินิจฉัย
แก้โรคจะวินิจฉัยจากอาการและประวัติ โดยจะทดสอบตรวจเพิ่มก็ต่อเมื่ออาการรุนแรง การทดสอบตรวจเพิ่มรวมการตรวจเลือด การป้ายกวาดตรวจสารคัดหลั่งที่ตา จมูก และคอ การตรวจอุจจาระ และการเอกซเรย์ปอด[34] ในห้องปฏิบัติการ อะดีโนไวรัสระบุได้โดยตรวจแอนติเจน ปฏิกิริยาลูกโซ่พอลิเมอเรส (PCR) การแยกไวรัส และการตรวจทางวิทยาเซรุ่ม ซึ่งแม้จะพบอะดีโนไวรัส แต่ก็อาจไม่ใช่เหตุของอาการ คนไข้มีภูมิอ่อนแอบางคนอาจกระจายไวรัสเป็นสัปดาห์ ๆ โดยไม่มีอาการอะไร[35]
การติดเชื้อ
แก้การติดเชื้ออะดีโนไวรัสโดยมากเป็นการติดเชื้อทางเดินลมหายใจด้านบน มักมีอาการเป็นเยื่อตาอักเสบ ทอนซิลอักเสบ (ซึ่งอาจเหมือนกับคอหอยอักเสบจากเชื้อสเตร็ปโตค็อกคัสทุกอย่างโดยไม่สามารถแยกแยะได้ยกเว้นตรวจเชื้อ) การติดเชื้อในหู หรือกล่องเสียงอักเสบอุดกั้น (croup) อะดีโนไวรัสเซโรไทป์ 40 และ 41 ยังอาจเป็นเหตุแก่กระเพาะอาหารและลำไส้อักเสบ[36] การมีทั้งเยื่อตาอักเสบและทอนซิลอักเสบสามัญเป็นพิเศษในการติดเชื้ออะดีโนไวรัส
เด็กบางคน (โดยเฉพาะที่อายุน้อยสุด) สามารถเกิดหลอดลมฝอยอักเสบหรือปอดบวมเหตุอะดีโนไวรัสได้ โดยทั้งสองอาจมีอาการรุนแรง ในทารก อะดีโนไวรัสอาจทำให้ไออย่างรุนแรงเหมือนกับโรคไอกรนเลย อะดีโนไวรัสยังอาจก่อเยื่อหุ้มสมองอักเสบหรือสมองอักเสบ และน้อยครั้ง อาจก่อกระเพาะปัสสาวะอักเสบแบบตกเลือด (hemorrhagic cystitis)
คนโดยมากฟื้นสภาพจากการติดเชื้ออะดีโนไวรัสเอง แต่คนที่ภูมิคุ้มกันบกพร่องบางครั้งอาจเสียชีวิต คนสุขภาพดีก็พบเสียชีวิตเหมือนกันแต่น้อยครั้ง[37] ซึ่งอาจเป็นเพราะการติดเชื้ออะดีโนไวรัสบางครั้งทำให้เกิดโรคหัวใจ ตัวอย่างเช่น ในงานศึกษาหนึ่ง คนไข้บางคนที่มีอาการ dilated cardiomyopathy[K] ได้ตรวจพบอะดีโนไวรัสเซโรไทป์ 8[38]
อะดีโนไวรัสมักจะแพร่ไปตามเสมหะ/น้ำลาย แต่ก็อาจติดเมื่อสัมผัสบุคคลที่ติดเชื้อ หรือติดจากอนุภาคไวรัสที่เหลืออยู่บนสิ่งต่าง ๆ เช่น ผ้าเช็ดตัวหรือก๊อกน้ำ ผู้ที่มีโรคกระเพาะอักเสบเหตุอะดีโนไวรัสอาจกระจายไวรัสในอุจจาระเป็นเดือน ๆ ก่อนจะหายดี ไวรัสอาจจะไปตามน้ำในสระน้ำถ้าไม่ใส่คลอรีนพอ
เหมือนกับโรคหลายอย่างอื่น ๆ การล้างมือให้สะอาดเป็นวิธีหนึ่งในการยับยั้งการแพร่เชื้อ ความร้อนและน้ำยาฟอกขาวสามารถฆ่าไวรัสบนวัตถุต่าง ๆ ได้[39]
การรักษา
แก้ยังไม่มียาต้านไวรัสที่พิสูจน์ว่ารักษาการติดเชื้ออะดีโนไวรัสได้ ดังนั้น การรักษาปกติจะมุ่งแก้อาการต่าง ๆ (เช่น ให้พาราเซตามอลเมื่อเป็นไข้ ) ยาต้านไวรัสคือ cidofovir ได้ช่วยคนไข้อาการหนักบางคน แต่จำนวนคนไข้ที่ช่วย ช่วยแค่ไหน ช่วยภาวะแทรกซ้อนหรืออาการอะไร เมื่อไรและที่ไหนที่เกิด ก็ไม่ได้กล่าวไว้[40] หมออาจให้ยาหยอดตาปฏิชีวนะเพื่อแก้เยื่อตาอักเสบเมื่อกำลังรอผลเพาะเชื้อโรค และเพื่อช่วยป้องกันการติดเชื้อแบคทีเรียที่เกิดขึ้นต่างหาก ปัจจุบันยังไม่มีวัคซีนอะดีโนไวรัสสำหรับบุคคลทั่วไป แต่วัคซีนสำหรับไวรัสเซโรไทป์ 4 และ 7 เคยมีสำหรับทหารสหรัฐ
การใช้ในยีนบำบัดและวัคซีน
แก้ยีนบำบัด
แก้อะดีโนไวรัสเป็นเวกเตอร์ไวรัสที่นิยมสำหรับยีนบำบัดเป็นเวลานานเพราะสามารถติดเซลล์ทั้งที่แบ่งตัวและไม่แบ่งตัว มีจีโนมใหญ่พอรองรับยีนที่ต้องการจะผสม (transgene) และสามารถสร้างโปรตีนโดยไม่รวมเข้ากับจีโนมของเซลล์ถูกเบียน[41] โดยเฉพาะก็คือ ไวรัสสามารถใช้เป็นพาหะในวิธีการรักษามะเร็งที่เรียกว่า targeted therapy[L][43] ในรูปแบบของดีเอ็นเอลูกผสม (recombinant DNA) หรือโปรตีนลูกผสม (recombinant protein) วิธีนี้มีประโยชน์เป็นพิเศษในการรักษาโรคเหตุยีนเดียว (monogenic เช่น ซิสติกไฟโบรซิส, X-linked severe combined immunodeficiency, Alpha 1-antitrypsin deficiency) และมะเร็ง[41] ประเทศจีนได้อนุมัติให้ใช้อะดีโนไวรัสสลายเนื้องอก (oncolytic adenovirus) เพื่อรักษามะเร็ง[44] โปรตีนใย (fibre protein) จะดัดแปลงโดยเฉพาะ ๆ เพื่อเล็งอะดีโนไวรัสไปที่เซลล์เป้าหมายโดยเฉพาะ[45] โดยความพยายามหลักอย่างหนึ่งก็คือจำกัดความเป็นพิษต่อตับและป้องกันอวัยวะต่าง ๆ ล้มเหลว อะดีโนไวรัสทรงสิบสองหน้า (dodecahedron) อาจเป็นวิธีการส่งแอนติเจนแปลกปลอมเข้าไปยัง myeloid dendritic cells (MDC) ที่ดี โดย MDC ก็จะแสดงแอนติเจนให้กับลิมโฟไซต์แบบ M1-specific CD8+ T อย่างมีประสิทธิภาพ[46]
อะดีโนไวรัสได้ใช้ส่งระบบการตัดต่อยีนคือ CRISPR/Cas9 gene editing systems แต่การตอบสนองทางภูมิคุ้มกันอย่างเข้มแข็งต่อการติดเชื้อไวรัสก็เป็นอุปสรรคในการใช้กับคนไข้ ดูเหมือนว่า การใช้ adeno-associated virus (AAV) ซึ่งเป็นไวรัสต่างประเภทกัน จะมีอนาคตในการแก้ปัญหาการก่อภูมิคุ้มกัน แม้จะสามารถบรรจุยีนที่ต้องการได้น้อยกว่า[41]
วัคซีน
แก้เวกเตอร์อะดีโนไวรัสแบบแปลง/ลูกผสม (recombinant) รวมทั้งแบบขยายพันธุ์ต่อไม่ได้ (replication incompetent) โดยทฤษฎีสามารถใช้ส่งรหัสดีเอ็นเอสำหรับแอนติเจนหนึ่ง ๆ โดยเฉพาะ ๆ แต่จนกระทั่งถึงเดือนพฤษภาคม 2020 เมื่อกล่าวถึงการใช้เป็นวัคซีนโควิด-19 นักวิชาการคนหนึ่งยังสรุปว่า "ยังไม่สามารถให้ผลผลิตเป็นวัคซีนมนุษย์ที่มีประสิทธิภาพได้"[47]
วัคซีนอะดีโนไวรัสชนิด 5 ลูกผสม (Ad5-nCoV[48], ImmunityBio, UQ-CSL V451) และชนิด 26 (Ad26.COV2.S) ต่างก็กำลังวิจัยเป็นวัคซีนโควิด-19[49] ส่วนวัคซีน Gam-COVID-Vac (หรือสปุตนิกวี ของรัสเซีย) เป็นนวัตกรรมใหม่เพราะใช้อะดีโนไวรัสชนิดที่ 26 ในการฉีดครั้งแรกวันแรก แล้วใช้วัคซีนชนิดที่ 5 ในการฉีดครั้งที่ 2 ในวันที่ 21[49] "ในวัคซีนโควิด-19 แคนดิเดต 4 อย่าง Ad5 ได้ใช้เป็นเวกเตอร์ในการส่งยีนโปรตีนผิวของไวรัส SARS-CoV-2"[50] เป้าหมายก็คือเพื่อให้เซลล์แสดงออกยีนไกลโคโปรตีนแบบ spike ของไวรัสโควิด-19
วัคซีนที่ใช้เวกเตอร์เป็นอะดีโนไวรัสของชิมแปนซีที่ขยายพันธุ์ไม่ได้ (ChAdOx1) ก็กำลังทดลองใช้เป็นวัคซีนโควิด-19 ด้วย[51] โดยเรียกว่า ChAdOx1 nCoV-19 (มหาวิทยาลัยออกซฟอร์ด) หรือ AZD1222 (บริษัทแอสตราเซเนกา) วัคซีนอีกอย่างก็คือ ChAd-SARS-CoV-2-S ซึ่งได้รายงานว่าป้องกันหนูไม่ให้ติดไวรัสโควิด-19 เป็นหนูที่ได้แปลงพันธุกรรมให้มีหน่วยรับแบบ ACE2 ของมนุษย์ (hACE2) ซึ่งเป็นหน่วยรับที่เชื่อว่าทำให้ไวรัสเข้าไปในเซลล์ได้[52][53]
ปัญหาเกี่ยวกับการใช้วัคซีนมีอะดีโนไวรัสเป็นเวกเตอร์ก็คือ มนุษย์อาจสร้างภูมิคุ้มกันต่อต้านเวกเตอร์เอง แล้วทำให้วัคซีนโดสที่สองไม่ได้ผล[54] ในบางกรณี คนที่มีภูมิต้านทานต่ออะดีโนไวรัสอยู่แล้ว ก็จะทำให้วัคซีนไม่ได้ผลเลย[55]
การใช้วัคซีนมี Ad5 เป็นเวกเตอร์สำหรับโควิด-19 ยังก่อความกังวลแก่นักวิจัยที่ทดลองวัคซีน Ad5 แล้วล้มเหลว เพราะวัคซีนได้เพิ่มโอกาสติดไวรัส HIV-1 แก่คนไข้ชายบางกลุ่ม[56] ในเดือนตุลาคม 2020 นักวิจัยเหล่านี้ถึงได้กับตีพิมพ์ในวารสารการแพทย์เดอะแลนซิต ว่า "อาศัยข้อค้นพบเหล่านี้ พวกเราเป็นห่วงว่า การใช้เวกเตอร์ Ad5 เพื่อสร้างภูมิคุ้มกันต่อ SARS-CoV-2 อาจเพิ่มความเสี่ยงการติดเชื้อ HIV-1 ในบรรดาชายที่ได้รับวัคซีนนี้เช่นกัน"[57][58] ในนัยกลับกัน บทความในวารสารวิทยาศาสตร์ไซเอินซ์ รายงานว่า ประเทศจีนได้อนุมัติวัคซีนอีโบลาที่ใช้เวกเตอร์ Ad5 วัคซีนเป็นของบริษัทจีนคือ CanSino Biologics และได้ทดสอบในประเทศเซียร์ราลีโอนซึ่งมีความชุกเอชไอวีสูง ซึ่งควรทำให้ปัญหาเยี่ยงนี้ปรากฏได้ง่าย แต่ประธานบริหารของบริษัทก็กล่าวว่า บริษัทไม่เห็นอะไรผิดปกติกับวัคซีนอีโบลาของบริษัท และคาดว่า การไวติดเชื้อเอชไอวีอาจจำกัดกับวัคซีน Ad5 ที่สร้างโปรตีนของเอชไอวี อนึ่ง ในรายงานที่ตีพิมพ์ในเดอะแลนซิตเช่นกันในเดือนพฤษภาคม นักวิจัยของบริษัทยอมรับว่ามีข้อกังวลซึ่งยัง "เป็นเรื่องโต้เถียงกันอยู่" นี้ และตนจะระวังเมื่อทดสอบวัคซีนโควิด-19 (Ad5-nCoV) ของบริษัท[50][48]
เชิงอรรถ
แก้- ↑ 1.0 1.1 1.2 เซโรไทป์ (อังกฤษ: serotype, serovar) เป็นรูปแบบต่าง ๆ กันของแบคทีเรียหรือไวรัสสปีชีส์หนึ่ง ๆ หรือเซลล์ภูมิคุ้มกันต่อต้านแบคทีเรียหรือไวรัสหนึ่ง ๆ จุลชีพ ไวรัส หรือเซลล์เหล่านี้จัดเข้าหมวดด้วยกันโดยอาศัยแอนติเจนซึ่งอยู่ที่ผิว เป็นการจัดหมวดหมู่ตามวิทยาการระบาดในระดับต่ำกว่าสปีชีส์[2][3][4]
- ↑ 2.0 2.1 สำหรับโปรตีน มอนอเมอร์กรดอะมิโนหน่วยหนึ่งอาจเรียกว่า เรซิดิว (อังกฤษ: residue) เพื่อระบุว่าเป็นหน่วยที่มีซ้ำ ๆ ในพอลิเมอร์
- ↑ 3.0 3.1 ไพรเมอร์ (อังกฤษ: primer) เป็นสายกรดนิวคลีอิกเส้นเดี่ยวที่ใช้เป็นจุดเริ่มต้นของการสังเคราะห์ดีเอ็นเอในสิ่งมีชีวิตทั้งหมด เพราะเอนไซม์ที่ทำหน้าที่ถ่ายแบบดีเอ็นเอ คือ DNA polymerase สามารถเพียงแค่เติมนิวคลีโอไทด์ใหม่ ๆ เข้าที่ปลาย 3' ของกรดนิวคลีอิกที่มีอยู่แล้ว จึงต้องมีไพรเมอร์ซึ่งเป็นกรดนิวคลีอิกอยู่ที่แบบดีเอ็นเอก่อนจะสามารถเริ่มสร้างสายดีเอ็นเอที่คู่กัน
- ↑ แคปโซเมียร์ (อังกฤษ: capsomere) เป็นหน่วยย่อยของแคปซิด (capsid) เป็นตัวปกคลุมด้านนอกของโปรตีนที่ป้องกันยีนของไวรัส แคปโซเมียร์จะรวมตัวเป็นแคปซิด[15]
- ↑ 5.0 5.1 รูนิวเคลียส (อังกฤษ: nuclear pore) เป็นคอมเพล็กซ์โปรตีนขนาดใหญ่ซึ่งทอดข้ามเยื่อหุ้มนิวเคลียส (nuclear envelope) อันเป็นเยื่อสองชั้นรอบ ๆ นิวเคลียสของเซลล์ยูแคริโอต เยื่อหุ้มนิวเคลียสของเซลล์สัตว์เลี้ยงลูกด้วยนมโดยเฉลี่ยจะมีคอมเพล็กซ์รูนิวเคลียส (อังกฤษ: nuclear pore complex ตัวย่อ NPC) 2,000 ช่อง แต่ก็ต่าง ๆ กันขึ้นอยู่กับชนิดเซลล์และกับช่วงชีวิตของเซลล์[18]
- ↑ primary transcript เป็นอาร์เอ็นเอสายเดี่ยวที่สังเคราะห์จากการถอดรหัสดีเอ็นเอ แล้วผ่านกระบวนต่าง ๆ เพื่อให้ได้ผลิตภัณฑ์อาร์เอ็นเอต่าง ๆ รวมทั้ง mRNA, tRNA และ rRNA
- ↑ alternative splicing หรือ differential splicing เป็นกระบวนการ RNA splicing ทางเลือกในช่วงการแสดงออกของยีน ที่ทำให้ยีนเดี่ยว ๆ สามารถเข้ารหัสโปรตีนได้หลายอย่าง ในกระบวนการนี้ exon ของยีนโดยเฉพาะ ๆ อาจรวมเข้าหรือคัดออกจากผลิตภัณฑ์คือเอ็มอาร์เอ็นเอที่ทำมาจากยีนนั้น ๆ[20] ดังนั้น โปรตีนที่แปลรหัสจากเอ็มอาร์เอ็นเอที่ได้จากกระบวนการนี้อย่างหนึ่งโดยเฉพาะ จะมีลำดับกรดอะมิโนที่ต่างกันกับที่ได้จากกระบวนการ splicing อื่น ๆ และมักจะมีหน้าที่ทางชีวภาพต่างกัน กระบวนการนี้จึงทำให้จีโนมมนุษย์สามารถใช้สังเคราะห์โปรตีนมากชนิดยิ่งกว่าที่จะคาดได้จากยีนที่เข้ารหัสโปรตีนเพียง 20,000 ชนิด
- ↑ โมเลกุลเอ็มอาร์เอ็นเอหนึ่ง ๆ จัดว่าเป็น monocistronic ต่อเมื่อมันมีข้อมูลยีนให้แปลรหัสเป็นโซ่โปรตีน (polypeptide) เพียงอย่างเดียว ซึ่งก็เป็นเช่นนี้สำหรับเอ็มอาร์เอ็นเอของเซลล์ยูแคริโอตโดยมาก[21][22]
- ↑ ค้างคาว Myotis หรือ mouse-eared bat (ค้างคาวหูหนู) เป็นสกุลค้างคาวในวงศ์ Vespertilionidae ที่มีสมาชิกหลากหลากและอยู่อย่างกว้างขวาง
- ↑ lesser Asiatic yellow bat (ค้างคาวเพดานเล็ก, Scotophilus kuhlii) เป็นสปีชีส์ค้างคาวในวงศ์ Vespertilionidae ที่พบในประเทศบังกลาเทศ อินเดีย อินโดนีเซีย มาเลเซีย ปากีสถาน ฟิลิปปินส์ ศรีลังกา และไต้หวัน[26]
- ↑ dilated cardiomyopathy (DCM) เป็นภาวะที่หัวใจโตและไม่สามารถสูบฉีดเลือดได้อย่างมีประสิทธิภาพ ซึ่งอาจมีผลต่อปอด ตับ และระบบในร่างกายอื่น ๆ
- ↑ targeted therapy หรือ molecularly targeted therapy เป็นวิธีหลักอย่างหนึ่งในการรักษามะเร็งด้วยยา วิธีอื่น ๆ รวมฮอร์โมนบำบัดและเคมีบำบัดที่เป็นพิษต่อเซลล์ เป็นยาในสาขา molecular medicine การบำบัดจะยับยั้งการเติบโตของเซลล์มะเร็งโดยขัดขวางโมเลกุลเป้าหมายหนึ่ง ๆ โดยเฉพาะที่จำเป็นในการก่อมะเร็งและการเติบโตของเนื้องอก[42] ไม่ได้ขัดขวางการแบ่งเซลล์อย่างรวดเร็วทั้งหมดเหมือนกับเคมีบำบัดทั่วไป
อ้างอิง
แก้- ↑ Rowe, WP; Huebner, RJ; Gilmore, LK; Parrott, RH; Ward, TG (December 1953). "Isolation of a cytopathogenic agent from human adenoids undergoing spontaneous degeneration in tissue culture". Proceedings of the Society for Experimental Biology and Medicine. 84 (3): 570–3. doi:10.3181/00379727-84-20714. PMID 13134217. S2CID 3097955.
- ↑ Baron, EJ (1996). Baron, S; และคณะ (บ.ก.). Classification. Baron's Medical Microbiology (4th ed.). Univ of Texas Medical Branch. ISBN 0-9631172-1-1.
- ↑ Ryan, KJ; Ray, CG, บ.ก. (2004). Sherris Medical Microbiology (4th ed.). McGraw Hill. ISBN 0-8385-8529-9.
- ↑ "serovar". The American Heritage Medical Dictionary. Houghton Mifflin Company. 2007.
- ↑ Dhingra, Akshay; Hage, Elias; Ganzenmueller, Tina; Böttcher, Sindy; Hofmann, Jörg; Hamprecht, Klaus; Obermeier, Patrick; Rath, Barbara; Hausmann, Fabian; Dobner, Thomas; Heim, Albert (2019-01-31). "Molecular Evolution of Human Adenovirus (HAdV) Species C". Scientific Reports (ภาษาอังกฤษ). 9 (1): 1039. doi:10.1038/s41598-018-37249-4. ISSN 2045-2322.
- ↑ Walsh, MP; Seto, J; Liu, EB; Dehghan, S; Hudson, NR; Lukashev, AN; Ivanova, O; Chodosh, J; Dyer, DW; Jones, MS; Seto, D (October 2011). "Computational analysis of two species C human adenoviruses provides evidence of a novel virus". Journal of Clinical Microbiology. 49 (10): 3482–90. doi:10.1128/JCM.00156-11. PMC 3187342. PMID 21849694.
- ↑ Robinson, CM; Singh, G; Henquell, C; Walsh, MP; Peigue-Lafeuille, H; Seto, D; Jones, MS; Dyer, DW; Chodosh, J (January 2011). "Computational analysis and identification of an emergent human adenovirus pathogen implicated in a respiratory fatality". Virology. 409 (2): 141–7. doi:10.1016/j.virol.2010.10.020. PMC 3006489. PMID 21056888.
- ↑ Singh, G; Robinson, CM; Dehghan, S; Schmidt, T; Seto, D; Jones, MS; Dyer, DW; Chodosh, J (February 2012). "Overreliance on the hexon gene, leading to misclassification of human adenoviruses". Journal of Virology. 86 (8): 4693–5. doi:10.1128/jvi.06969-11. PMC 3318657. PMID 22301156.
- ↑ Singh, G; Zhou, X; Lee, JY; Yousuf, MA; Ramke, M; Ismail, AM; Lee, JS; Robinson, CM; Seto, D; Dyer, DW; Jones, MS; Rajaiya, J; Chodosh, J (November 2015). "Recombination of the Epsilon Determinant and Corneal Tropism: Human Adenovirus Species D Types 15, 29, 56, and 69". Virology. 485: 452–459. doi:10.1016/j.virol.2015.08.018. PMC 4619159. PMID 26343864.
- ↑ Jones, MS; Harrach, B; Ganac, RD; Gozum, MM; WP, Dela Cruz; Riedel, B; Pan, C; Delwart, EL; Schnurr, DP (June 2007). "New adenovirus species found in a patient presenting with gastroenteritis". Journal of Virology. 81 (11): 5978–84. doi:10.1128/JVI.02650-06. PMC 1900323. PMID 17360747.
- ↑ Voss, JD; Atkinson, RL; Dhurandhar, NV (November 2015). "Role of adenoviruses in obesity". Reviews in Medical Virology. 25 (6): 379–87. doi:10.1002/rmv.1852. PMID 26352001.
- ↑ Martin, Malcolm A.; Knipe, David M.; Fields, Bernard N.; Howley, Peter M.; Griffin, Diane; Lamb, Robert (2007). Fields' virology. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins. p. 2395. ISBN 978-0-7817-6060-7.
- ↑ "Scientists Unveil Structure of Adenovirus, the Largest High-Resolution Complex Ever Found". Science Daily. August 2010. สืบค้นเมื่อ 2010-08-30.
- ↑ Harrison, SC (August 2010). "Virology. Looking inside adenovirus". Science. 329 (5995): 1026–7. Bibcode:2010Sci...329.1026H. doi:10.1126/science.1194922. PMID 20798308. S2CID 206528739.
- ↑ Weeks, Benjamin S (2012). Alcamo's Microbes and Society. Jones & Bartlett. pp. 113. ISBN 978-0-7637-9064-6.
- ↑ Wu, E; Nemerow, GR (April 2004). "Virus yoga: the role of flexibility in virus host cell recognition". Trends in Microbiology. 12 (4): 162–9. doi:10.1016/j.tim.2004.02.005. PMID 15051066.
- ↑ Flint, Jane; Skalka, Anna Marie; Rall, Glenn F.; Racaniello, Vincent R. (2015). Principles of Virology. Vol. Volume I: Molecular Biology. doi:10.1128/9781555818951. ISBN 9781555819330.
{{cite book}}:|volume=has extra text (help) - ↑ Maul, Gerd G; Deaven, Larry (June 1977). "Quantitative Determination of Nuclear Pore Complexes in Cycling Cells with Differing DNA Content" (PDF). Journal of Cell Biology. 73 (3): 748–760. doi:10.1083/jcb.73.3.748. eISSN 1540-8140. PMID 406262. สืบค้นเมื่อ 12 December 2014.
- ↑ Meier, O; Greber, UF (February 2004). "Adenovirus endocytosis". The Journal of Gene Medicine. 6 Suppl 1 (Suppl 1): S152-63. doi:10.1002/jgm.553. PMID 14978758.
- ↑ Black, Douglas L. (2003). "Mechanisms of alternative pre-messenger RNA splicing". Annual Review of Biochemistry. 72 (1): 291–336. doi:10.1146/annurev.biochem.72.121801.161720. PMID 12626338.
- ↑ Kozak, M. (March 1983). "Comparison of initiation of protein synthesis in procaryotes, eucaryotes, and organelles". Microbiological Reviews. 47 (1): 1–45. PMC 281560. PMID 6343825.
- ↑ Niehrs C; Pollet N (December 1999). "Synexpression groups in eukaryotes". Nature. 402 (6761): 483–7. doi:10.1038/990025. PMID 10591207.
- ↑ 23.0 23.1 Yamamoto, H; Shimojo, H (August 1971). "Multiplicity reactivation of human adenovirus type 12 and simian virus 40 irradiated by ultraviolet light". Virology. 45 (2): 529–31. doi:10.1016/0042-6822(71)90355-2. PMID 4328814.
- ↑ Michod, RE; Bernstein, H; Nedelcu, AM (May 2008). "Adaptive value of sex in microbial pathogens" (PDF). Infection, Genetics and Evolution. 8 (3): 267–85. doi:10.1016/j.meegid.2008.01.002. PMID 18295550. คลังข้อมูลเก่าเก็บจากแหล่งเดิม (PDF)เมื่อ 2020-05-11. สืบค้นเมื่อ 2021-01-19.
- ↑ Wan, Y. Y.; Leon, R. P.; Marks, R.; Cham, C. M.; Schaack, J.; Gajewski, T. F.; DeGregori, J. (2000). "Transgenic expression of the coxsackie/adenovirus receptor enables adenoviral-mediated gene delivery in naive T cells". Proceedings of the National Academy of Sciences. 97 (25): 13784–13789. doi:10.1073/pnas.250356297. ISSN 0027-8424.
- ↑ Chen, LH; Wu, ZQ; Hu, YF; Yang, F; Yang, J; Jin, Q (June 2012). "[Genetic diversity of adenoviruses in bats of China]". Bing du Xue Bao = Chinese Journal of Virology. 28 (4): 403–8. PMID 22978165.
- ↑ Li, Y; Ge, X; Zhang, H; Zhou, P; Zhu, Y; Zhang, Y; Yuan, J; Wang, LF; Shi, Z (April 2010). "Host range, prevalence, and genetic diversity of adenoviruses in bats". Journal of Virology. 84 (8): 3889–97. doi:10.1128/JVI.02497-09. PMC 2849498. PMID 20089640.
- ↑ 28.0 28.1 Fenner, Frank J.; Gibbs, E. Paul J.; Murphy, Frederick A.; Rott, Rudolph; Studdert, Michael J.; White, David O. (1993). Veterinary Virology (2nd ed.). Academic Press, Inc. ISBN 978-0-12-253056-2.
- ↑ Goldstein, T; Colegrove, KM; Hanson, M; Gulland, FM (May 2011). "Isolation of a novel adenovirus from California sea lions Zalophus californianus". Diseases of Aquatic Organisms. 94 (3): 243–8. doi:10.3354/dao02321. PMID 21790072.
- ↑ "Inclusion Body Hepatitis and Hepatitis Hydropericardium Syndrome in Poultry - Poultry". Veterinary Manual (ภาษาอังกฤษ).
- ↑ Kumar, R; Kumar, V; Asthana, M; Shukla, SK; Chandra, R (January 2010). "Isolation and identification of a fowl adenovirus from wild Black Kites (Milvus migrans)". Journal of Wildlife Diseases. 46 (1): 272–6. doi:10.7589/0090-3558-46.1.272. PMID 20090043.
- ↑ Chen, EC; Yagi, S; Kelly, KR; Mendoza, SP; Tarara, RP; Canfield, DR; Maninger, N; Rosenthal, A; Spinner, A; Bales, KL; Schnurr, DP; Lerche, NW; Chiu, CY (July 2011). Nemerow, GR (บ.ก.). "Cross-species transmission of a novel adenovirus associated with a fulminant pneumonia outbreak in a new world monkey colony". PLOS Pathogens. 7 (7): e1002155. doi:10.1371/journal.ppat.1002155. PMC 3136464. PMID 21779173.
- ↑ 33.0 33.1 "Adenovirus | Prevention and Treatment | CDC". 2019-09-03.
- ↑ "Default - Stanford Children's Health". คลังข้อมูลเก่าเก็บจากแหล่งเดิมเมื่อ 2020-04-03. สืบค้นเมื่อ 2021-01-19.
- ↑ "Adenovirus | Clinical Diagnosis | CDC". 2019-08-29.
- ↑ Wadell G.; และคณะ (1987). Whelan, Julie; Bock, Gregory (บ.ก.). Novel diarrhoea viruses. New York: Wiley. p. 63. ISBN 978-0-471-91094-7.
- ↑ Amy Burkholder (2007-12-19). "A killer cold? Even the healthy may be vulnerable". CNN. สืบค้นเมื่อ 2007-12-19.
- ↑ Hosseini, SM; Mirhosseini, SM; Taghian, M; Salehi, M; Farahani, MM; Bakhtiari, F; Ghasemi-Pirbaluti, M; Motaghi, E (October 2018). "First evidence of the presence of adenovirus type 8 in myocardium of patients with severe idiopathic dilated cardiomyopathy". Archives of Virology. 163 (10): 2895–2897. doi:10.1007/s00705-018-3942-3. PMID 30022238. S2CID 49870344.
- ↑ "Chemical Disinfectants, Guideline for Disinfection and Sterilization in Healthcare Facilities". National Center for Emerging and Zoonotic Infectious Diseases. 2008. สืบค้นเมื่อ 2021-05-30.
- ↑ Fox, Maggie (2018-01-28). "Adenovirus looks like flu, acts like flu, but it's not influenza". NBC News.
- ↑ 41.0 41.1 41.2 Lee, CS; Bishop, ES; Zhang, R; Yu, X; Farina, EM; Yan, S; Zhao, C; Zheng, Z; Shu, Y; Wu, X; Lei, J; Li, Y; Zhang, W; Yang, C; Wu, K; Wu, Y; Ho, S; Athiviraham, A; Lee, MJ; Wolf, JM; Reid, RR; He, TC (June 2017). "Adenovirus-Mediated Gene Delivery: Potential Applications for Gene and Cell-Based Therapies in the New Era of Personalized Medicine". Genes & Diseases. 4 (2): 43–63. doi:10.1016/j.gendis.2017.04.001. PMC 5609467. PMID 28944281.
- ↑ "Definition of targeted therapy". NCI Dictionary of Cancer Terms.
- ↑ Thacker, EE; Nakayama, M; Smith, BF; Bird, RC; Muminova, Z; Strong, TV; Timares, L; Korokhov, N; O'Neill, AM; de Gruijl, TD; Glasgow, JN; Tani, K; Curiel, DT (November 2009). "A genetically engineered adenovirus vector targeted to CD40 mediates transduction of canine dendritic cells and promotes antigen-specific immune responses in vivo". Vaccine. 27 (50): 7116–24. doi:10.1016/j.vaccine.2009.09.055. PMC 2784276. PMID 19786146.
- ↑ Harrington, KJ; Vile, RG; Pandha, HS, บ.ก. (May 2008). Viral Therapy of Cancer. Hoboken, N.J.: Wiley. pp. 1-13. ISBN 9780470019221.
- ↑ Xin, KQ; Sekimoto, Y; Takahashi, T; Mizuguchi, H; Ichino, M; Yoshida, A; Okuda, K (May 2007). "Chimeric adenovirus 5/35 vector containing the clade C HIV gag gene induces a cross-reactive immune response against HIV". Vaccine. 25 (19): 3809–15. doi:10.1016/j.vaccine.2007.01.117. PMID 17386962.
- ↑ Naskalska, A; Szolajska, E; Chaperot, L; Angel, J; Plumas, J; Chroboczek, J (December 2009). "Influenza recombinant vaccine: matrix protein M1 on the platform of the adenovirus dodecahedron". Vaccine. 27 (52): 7385–93. doi:10.1016/j.vaccine.2009.09.021. PMID 19766576.
- ↑ Cross, Ryan (2020-05-12). "Adenoviral vectors are the new COVID-19 vaccine front-runners. Can they overcome their checkered past?". Chemical & Engineering News. 98 (19). สืบค้นเมื่อ 2020-12-15.
- ↑ 48.0 48.1 Zhu, FC; Li, YH; Guan, XH; Hou, LH; Wang, WJ; Li, JX; และคณะ (June 2020). "Safety, tolerability, and immunogenicity of a recombinant adenovirus type-5 vectored COVID-19 vaccine: a dose-escalation, open-label, non-randomised, first-in-human trial". Lancet. 395 (10240): 1845–1854. doi:10.1016/s0140-6736(20)31208-3. PMC 7255193. PMID 32450106.
- ↑ 49.0 49.1 "An Open Study of the Safety, Tolerability and Immunogenicity of the Drug "Gam-COVID-Vac" Vaccine Against COVID-19". Clinical Trials. 2020-06-22. สืบค้นเมื่อ 2020-12-22.
- ↑ 50.0 50.1 Cohen, Jon (2020-10-19). "Could certain COVID-19 vaccines leave people more vulnerable to the AIDS virus?". American Association for the Advancement of Science. Science (magazine). สืบค้นเมื่อ 2020-12-15.
- ↑ Folegatti, PM; Ewer, KJ; Aley, PK; Angus, B; Becker, S; Belij-Rammerstorfer, S; และคณะ (2020-08-15). "Safety and immunogenicity of the ChAdOx1 nCoV-19 vaccine against SARS-CoV-2: a preliminary report of a phase 1/2, single-blind, randomised controlled trial". Lancet. 396 (10249): 467–478. doi:10.1016/S0140-6736(20)31604-4. PMC 7445431. PMID 32702298.
- ↑ "Experimental Nasal Vaccine Protects Upper and Lower Respiratory Tracts against SARS-CoV-2". Sci News. 2020-08-27. สืบค้นเมื่อ 2020-08-28.
- ↑ Hassan, AO; Kafai, NM; Dmitriev, IP; Fox, JM; Smith, BK; Harvey, IB; และคณะ (2020-10-01). "A Single-Dose Intranasal ChAd Vaccine Protects Upper and Lower Respiratory Tracts against SARS-CoV-2". Cell. 183 (1): 169-184.e13. doi:10.1016/j.cell.2020.08.026. PMC 7437481. PMID 32931734.
- ↑ Logunov, DY; Dolzhikova, IV; Zubkova, OV; Tukhvatullin, AI; Shcheblyakov, DV; Dzharullaeva, AS; และคณะ (2020-09-26). "Safety and immunogenicity of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine in two formulations: two open, non-randomised phase 1/2 studies from Russia". Lancet. 396 (10255): 887–897. doi:10.1016/S0140-6736(20)31866-3. PMC 7471804. PMID 32896291.
- ↑ Fausther-Bovendo, H; Kobinger, GP (2014). "Pre-existing immunity against Ad vectors: humoral, cellular, and innate response, what's important?". Hum Vaccin Immunother. 10 (10): 2875–8284. doi:10.4161/hv.29594. PMC 5443060. PMID 25483662.
- ↑ Collins, Simon (2020-12-09). "HIV risk from some COVID-19 vaccines might be unlikely due to rarity of vector viruses involved". HIV i-BASE. สืบค้นเมื่อ 2020-12-15.
- ↑ Rosenberg, Jaime (2020-10-25). "Researchers Warn of Heightened Risk of HIV With Certain COVID-19 Vaccines". AJMC. สืบค้นเมื่อ 2020-12-15.
- ↑ Buchbinder, SP; McElrath, MJ; Dieffenbach, C; Corey, L (2020-10-31). "Use of adenovirus type-5 vectored vaccines: a cautionary tale". Lancet. 396 (10260): e68–e69. doi:10.1016/S0140-6736(20)32156-5. PMC 7571904. PMID 33091364.
แหล่งข้อมูลอื่น
แก้- Centers for Disease Control and Prevention—National Center for Diseases—Division of Viral and Rickettsial Diseases, Respiratory and Enteric Viruses Branch
- MicrobiologyBytes: Adenoviruses
- Stanford University—Adenoviruses
- Adenoviruses General Concepts
- General information on Adenovirus
- DNA virus replication strategies
- Sequenced adenoviruses เก็บถาวร 2021-01-26 ที่ เวย์แบ็กแมชชีน
- Kids Health—Adenoviruses
- Viralzone: Adenoviridae เก็บถาวร 2010-06-20 ที่ เวย์แบ็กแมชชีน
- Adenovirus Research Discussion Group
- USAMRMC protects Soldiers against unseen enemy
- 3D macromolecular structures of Adenoviruses archived in the EM Data Bank (EMDB)
- Molecule of the Month: Adenovirus เก็บถาวร 2015-10-17 ที่ เวย์แบ็กแมชชีน
- ICTV