ซัลเฟอร์ไดออกไซด์
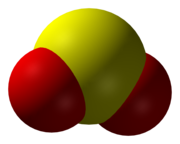
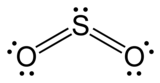
ซัลเฟอร์ไดออกไซด์ (สูตรทางเคมี SO2) เป็นออกไซด์ชนิดหนึ่งของกำมะถัน

| |
| |
| |
| ชื่อ | |
|---|---|
| IUPAC name
Sulfur dioxide
| |
| ชื่ออื่น
Sulfurous anhydride
Sulfur(IV) oxide | |
| เลขทะเบียน | |
3D model (JSmol)
|
|
| 3535237 | |
| ChEBI | |
| ChEMBL | |
| เคมสไปเดอร์ | |
| ECHA InfoCard | 100.028.359 |
| EC Number |
|
| เลขอี | E220 (preservatives) |
| 1443 | |
| KEGG | |
| MeSH | Sulfur+dioxide |
ผับเคม CID
|
|
| RTECS number |
|
| UNII | |
| UN number | 1079, 2037 |
CompTox Dashboard (EPA)
|
|
| |
| |
| คุณสมบัติ | |
| SO 2 | |
| มวลโมเลกุล | 64.066 g mol−1 |
| ลักษณะทางกายภาพ | แก๊สไม่มีสีและฉุน |
| กลิ่น | Pungent; similar to a just-struck match[1] |
| ความหนาแน่น | 2.6288 kg m−3[ต้องการอ้างอิง] |
| จุดหลอมเหลว | −72 องศาเซลเซียส; −98 องศาฟาเรนไฮต์; 201 เคลวิน |
| จุดเดือด | −10 องศาเซลเซียส (14 องศาฟาเรนไฮต์; 263 เคลวิน) |
| 94 g/L[2] forms sulfurous acid | |
| ความดันไอ | 230 kPa at 10 °C; 330 kPa at 20 °C; 462 kPa at 30 °C; 630 kPa at 40 °C[3] |
| pKa | ~1.81 |
| Basicity (pKb) | ~12.19 |
| −18.2·10−6 cm3/mol | |
| ความหนืด | 12.82 μPa·s[4] |
| โครงสร้าง | |
| C2v | |
| Digonal | |
| Dihedral | |
| 1.62 D | |
| อุณหเคมี | |
Std molar
entropy (S⦵298) |
248.223 J K−1 mol−1 |
Std enthalpy of
formation (ΔfH⦵298) |
−296.81 kJ mol−1 |
| ความอันตราย | |
| GHS labelling: | |
 
| |
| อันตราย | |
| H314, H331[5] | |
| NFPA 704 (fire diamond) | |
| ปริมาณหรือความเข้มข้น (LD, LC): | |
LC50 (median concentration)
|
3000 ppm (mouse, 30 min) 2520 ppm (rat, 1 hr)[7] |
LCLo (lowest published)
|
993 ppm (rat, 20 min) 611 ppm (rat, 5 hr) 764 ppm (mouse, 20 min) 1000 ppm (human, 10 min) 3000 ppm (human, 5 min)[7] |
| NIOSH (US health exposure limits): | |
PEL (Permissible)
|
TWA 5 ppm (13 mg/m3)[6] |
REL (Recommended)
|
TWA 2 ppm (5 mg/m3) ST 5 ppm (13 mg/m3)[6] |
IDLH (Immediate danger)
|
100 ppm[6] |
| สารประกอบอื่นที่เกี่ยวข้องกัน | |
| ซัลเฟอร์มอนอกไซด์ ซัลเฟอร์ไตรออกไซด์ ไดซัลเฟอร์มอนอกไซด์ | |
สารประกอบที่เกี่ยวข้อง
|
โอโซน ซีลีเนียมไดออกไซด์ Sulfurous acid เทลลูเรียมไดออกไซด์ |
หากมิได้ระบุเป็นอื่น ข้อมูลข้างต้นนี้คือข้อมูลสาร ณ ภาวะมาตรฐานที่ 25 °C, 100 kPa
| |
สมบัติทางเคมี
แก้- ซัลเฟอร์ไดออกไซด์สามารถทำปฏิกิริยากับออกซิเจนในอากาศได้เป็น ซัลเฟอร์ไตรออกไซด์ ดังสมการ
2SO2+O2→2SO3 ซึ่งก๊าซซัลเฟอร์ไตรออกไซด์นี้สามารถละลายน้ำเกิดเป็นสารละลายกรดซัลฟิวริก
- เป็นแอซิดิกออกไซด์ (ออกไซด์ของธาตุที่ทำปฏิกิริยากับน้ำได้สารละลายกรด) เมื่อทำปฏิกิริยากับน้ำได้กรดซัลฟิวรัส
อ้างอิง
แก้- ↑ Sulfur dioxide เก็บถาวร 2019-12-30 ที่ เวย์แบ็กแมชชีน, U.S. National Library of Medicine
- ↑ Lide, David R., บ.ก. (2006). CRC Handbook of Chemistry and Physics (87th ed.). Boca Raton, FL: CRC Press. ISBN 0-8493-0487-3.
- ↑ "Hazardous Substances Data Bank".
- ↑ Miller, J.W. Jr.; Shah, P.N.; Yaws, C.L. (1976). "Correlation constants for chemical compounds". Chemical Engineering. 83 (25): 153–180. ISSN 0009-2460.
- ↑ "C&L Inventory".
- ↑ 6.0 6.1 6.2 NIOSH Pocket Guide to Chemical Hazards. "#0575". National Institute for Occupational Safety and Health (NIOSH).
- ↑ 7.0 7.1 "Sulfur dioxide". Immediately Dangerous to Life and Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
